行業(yè)動態(tài)
您當(dāng)前的位置 > 行業(yè)動態(tài) > 行業(yè)新聞
最新優(yōu)先審評名單三大亮點(diǎn)
加入日期:2018/2/24 8:24:46 查看人數(shù): 943 作者:admin
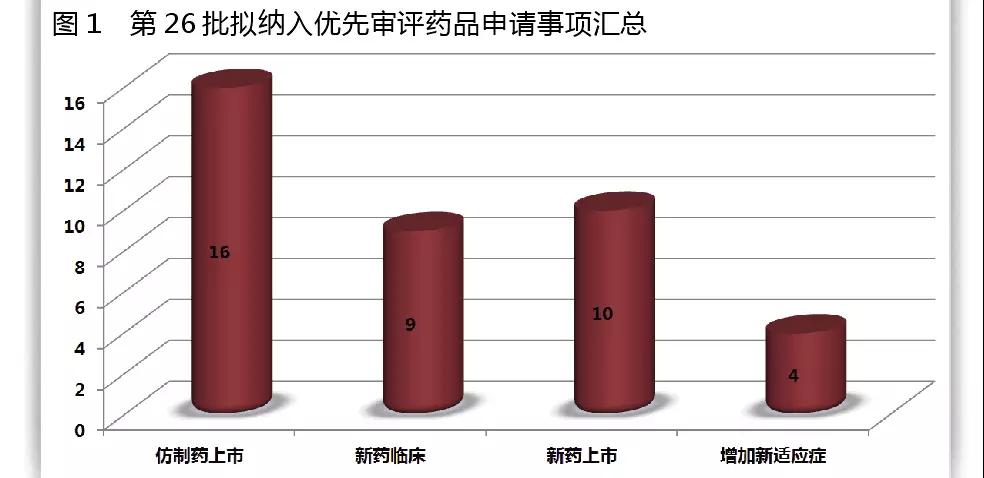
CFDA藥品審評中心發(fā)布的《擬納入優(yōu)先審評程序藥品注冊申請的公示(第二十六批)》,將39個擬優(yōu)先審評的藥品注冊申請及其申請人予以公示。據(jù)公示名單,此次入選的39個藥品中,16個藥品為仿制藥上市,9個藥品為新藥臨床,10個為新藥上市,4個為增加新適應(yīng)癥。
亮點(diǎn)一:三款CAR-T細(xì)胞藥物入選
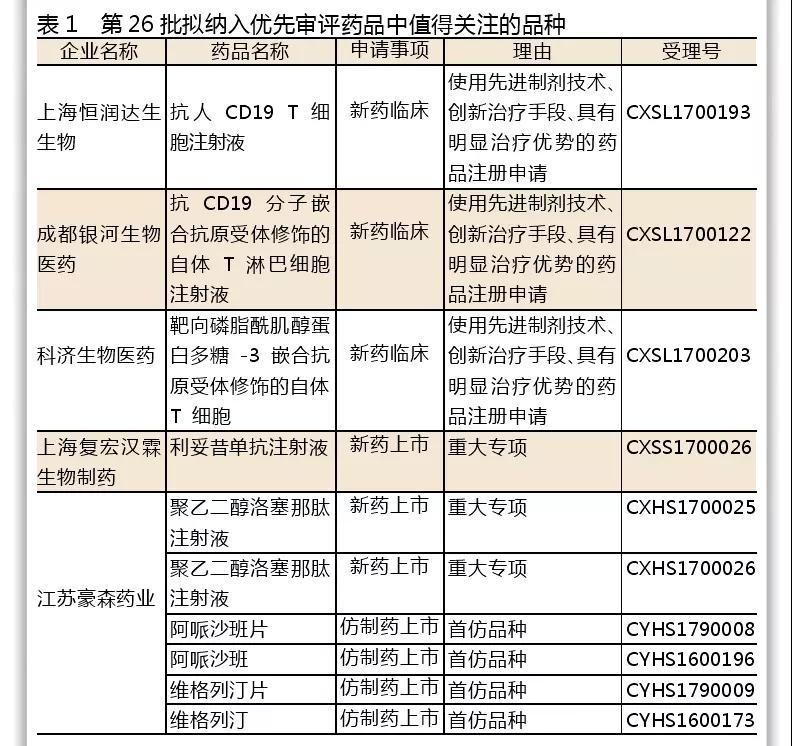
在第二十六批優(yōu)先審評名單中,入選的三款CAR-T細(xì)胞藥物是:上海恒潤達(dá)生、科濟(jì)生物和銀河生物的3個CAR-T療法的臨床申請。納入理由是:使用先進(jìn)制劑技術(shù)、創(chuàng)新治療手段、具有明顯治療優(yōu)勢的藥品注冊申請。
緊跟國際步伐
細(xì)胞治療技術(shù)是目前國際醫(yī)學(xué)前沿重點(diǎn)發(fā)展的領(lǐng)域,它給一些人類疑難疾病的治療提供了新希望。近年來,細(xì)胞治療領(lǐng)域不斷取得新的研究成果,細(xì)胞治療產(chǎn)品的研發(fā)與評價也日益受到國內(nèi)外制藥企業(yè)及各國政府的高度關(guān)注。2017年12月22日,CFDA發(fā)布《細(xì)胞治療產(chǎn)品研究與評價技術(shù)指導(dǎo)原則(試行)》,整個細(xì)胞治療領(lǐng)域?qū)⒂瓉硪?guī)范化發(fā)展,發(fā)展速度也將大大提升,國內(nèi)CAR-T細(xì)胞藥物申報快速跟進(jìn)國外研發(fā)速度,市場前景值得期待。
國內(nèi)細(xì)胞治療研發(fā)緊跟美國步伐,目前已有6家公司的臨床申請獲得受理,除此次納入優(yōu)先審評公示名單的3家公司之外,還有:2017年12月18日南京傳奇生物的CAR-T細(xì)胞自體回輸制劑被納入第25批優(yōu)先審評名單;2018年1月8日博生吉安科細(xì)胞技術(shù)公司的CD19T細(xì)胞注射劑;2018年1月12日上海名聚生物的JWCAR029已進(jìn)行申報。
獲批在望
目前,全球共有兩個CAR-T產(chǎn)品獲批上市,分別是諾華的Kymriah(tisagenlecleucel)和Kite制藥的Yescarta(KTE-C19)。Kymriah獲批用于治療兒童和年輕成人(2~25歲)的急性淋巴細(xì)胞白血?。ˋLL),年費(fèi)用47.5萬美元;Yescarta獲批用于治療特定類型大B細(xì)胞淋巴瘤,年費(fèi)用37.3萬美元。有專家預(yù)測,我國首個自主研發(fā)的CAR-T療法藥物有望在3年內(nèi)獲批,而年費(fèi)用也會降到人們可承受的范圍內(nèi),甚至是10萬元以內(nèi)。
亮點(diǎn)二:】國產(chǎn)首個生物類似藥上市沖刺
復(fù)星醫(yī)藥利妥昔單抗注射液上市申請被納入優(yōu)先審評公示名單,意味著首個國產(chǎn)生物類似藥上市進(jìn)入最后沖刺階段。
連續(xù)四年全球銷售過70億
利妥昔單抗由羅氏旗下基因泰克開發(fā),1997年11月獲準(zhǔn)在美國上市,商品名為“Rituxan”。1998年6月2日獲得歐洲EMA批準(zhǔn);2001年6月20日獲得日本PMDA批準(zhǔn);2008年4月21日獲CFDA批準(zhǔn)上市,并由百健和羅氏在美國、歐洲、日本和中國市場銷售。該產(chǎn)品主要用于非霍奇金淋巴瘤和淋巴細(xì)胞白血病的治療,為全球首個獲批的CD20類單抗。該藥是羅氏公司的主打品種,印度、俄羅斯和拉丁美洲幾個國家市場已經(jīng)有幾種仿制產(chǎn)品。
據(jù)全球暢銷藥數(shù)據(jù)統(tǒng)計,2016年利妥昔單抗銷售額為74.1億美元,同比增長1%。2005-2016年該產(chǎn)品年復(fù)合增長率為7.5%。2007年該藥全球銷售額突破50億美元,2013-2016年連續(xù)4年全球銷售額突破70億美元。該藥歐盟專利在2015年失效,并將于2018年在美國專利期滿。
國內(nèi)銷售增勢猛
據(jù)樣本醫(yī)院數(shù)據(jù)統(tǒng)計,利妥昔單抗2016年用藥金額為9.8億元,較同期增長23.5%,2005-2016年年復(fù)合增長率為28.1%。該產(chǎn)品自2012年起樣本醫(yī)院用藥金額過5億元,在國內(nèi)樣本醫(yī)院抗體藥物領(lǐng)域銷售額排名第一。在國內(nèi)市場剛性需求拉動下,繼續(xù)表現(xiàn)出強(qiáng)勁的增長態(tài)勢。
利妥昔單抗由羅氏于2000年獲批在國內(nèi)上市,商品名為“美羅華”,劑型為注射液,規(guī)格有500mg:50ml和100mg:10ml兩種。該產(chǎn)品是非霍奇金氏淋巴瘤的“金標(biāo)準(zhǔn)”治療藥物,并作為晚期結(jié)腸癌的一線用藥。
首仿產(chǎn)品預(yù)計年內(nèi)獲批
目前國內(nèi)正在申報利妥昔單抗的企業(yè)有復(fù)宏漢霖、正大天晴、華蘭基因、神州細(xì)胞、信達(dá)生物、浙江海正等。利妥昔單抗是復(fù)星醫(yī)藥第一個大分子單抗藥物,也是國內(nèi)首個生物類似藥。復(fù)星醫(yī)藥的子公司復(fù)宏漢霖利妥昔生物類似藥累計研發(fā)投入超過3億元,預(yù)計將在2018年內(nèi)獲批。據(jù)專業(yè)人士預(yù)測,該產(chǎn)品上市后市場潛力巨大,年銷售額有望超過30億元。目前復(fù)星醫(yī)藥大分子單抗藥物布局齊全,類似藥系列處于國內(nèi)前列,后續(xù)產(chǎn)品梯隊較為豐富。
亮點(diǎn)三:豪森坐擁三個重磅品種
江蘇豪森的重磅藥物聚乙二醇洛塞那肽、阿哌沙班、維格列汀均在此次公布的優(yōu)先審評名單中。未來幾年,這幾個重磅藥物將給豪森帶來新一輪飛躍。
國產(chǎn)原創(chuàng)長效GLP-1重磅
聚乙二醇洛塞那肽是由江蘇豪森自主研發(fā)的1類化藥,屬于長效GLP-1受體激動劑,擬用于單藥或與二甲雙胍聯(lián)合治療2型糖尿病,該產(chǎn)品每周只需注射1次。
2007年3月,豪森初次申報洛塞那肽化藥1.1類的臨床研究;2008年10月獲得臨床批件;2015年1月、7月完成兩項重要的Ⅲ期臨床試驗;2017年10月開始注冊受理;2017年12月6日進(jìn)入審評中心;2018年1月報產(chǎn)獲優(yōu)先審評。與此同時,洛塞那肽2008年入選國家“863計劃”,2010、2012年兩次獲得國家科技重大專項支持等。江蘇豪森該品種從初次申報臨床到報產(chǎn)獲優(yōu)先審評已經(jīng)走過了近11個年頭。
截至目前,全球共有7個GLP-1受體激動劑類藥物上市,其中,阿必魯肽、度拉糖肽、索馬魯肽以及注射用艾塞那肽微球均為每周注射1次的長效GLP-1受體激動劑。值得一提的是,2018年1月4日,三生制藥的GLP-1受體激動劑注射用艾塞那肽微球獲得CFDA批準(zhǔn)上市,用于2型糖尿病的治療。由此,三生制藥的注射用艾塞那肽微球成為國內(nèi)首個獲批上市的長效GLP-1受體激動劑。然而該藥并不是三生制藥自主研發(fā)的,2016年三生制藥與阿斯利康達(dá)成戰(zhàn)略合作,三生制藥擁有Byetta/百泌達(dá)和Bydureon/百達(dá)揚(yáng)的中國獨(dú)家商業(yè)權(quán)。而江蘇豪森的洛塞那肽是國產(chǎn)長效GLP-1受體激動劑,業(yè)內(nèi)人士估計該藥最早將于2018年第三季度獲批。
阿哌沙班爭搶仿
阿哌沙班由百時美施貴寶開發(fā),2013年1月獲準(zhǔn)在中國注冊,商品名為“艾樂妥”,主要用于髖關(guān)節(jié)或膝關(guān)節(jié)擇期置換術(shù)的成年患者預(yù)防靜脈血栓栓塞癥。劑型為片劑,規(guī)格為2.5mg。2016年阿哌沙班全球銷售額為33.43億美元,較2015年增長80%,銷售額幾乎翻番,增長迅猛。
據(jù)國內(nèi)樣本醫(yī)院數(shù)據(jù)統(tǒng)計,國內(nèi)阿哌沙班市場規(guī)模從2013年的116萬元增長到2015年的510萬元,2016年與2015年基本持平。2017年,阿哌沙班進(jìn)入國家新版醫(yī)保目錄,2017年1-3季度該藥銷售額已達(dá)534萬元。
經(jīng)檢索CFDA數(shù)據(jù)庫,目前國內(nèi)申報阿哌沙班制劑的企業(yè)有近30家,主要企業(yè)有江蘇豪森藥業(yè)、南京潤諾生物科技、正大天晴藥業(yè)、齊魯制藥(海南)、廣東東陽光藥業(yè)、山東新時代藥業(yè)等。百時美施貴寶的阿哌沙班在國內(nèi)申請的化合物專利2022年到期。據(jù)了解,此化合物正在走無效程序。一旦專利被無效掉,豪森的的首仿品種將第一時間進(jìn)入市場,并給其帶來不錯的業(yè)績。
維格列汀DPP-4首仿
維格列汀由諾華制藥研發(fā)。2007年9月28日,維格列汀獲得歐盟批準(zhǔn),商品名為“Galvus”,首先在歐盟國家及挪威和愛爾蘭上市。據(jù)全球暢銷藥數(shù)據(jù)統(tǒng)計,2012-2016年該藥銷售額分別為9.10億美元、12.00億美元、12.24億美元、11.85億美元、11.93億美元。該產(chǎn)品已連續(xù)五年銷售額超過10億美元。
2011年8月,諾華的維格列汀片獲準(zhǔn)進(jìn)入我國,商品名為“佳維樂”。目前國內(nèi)已上市多種DPP-4抑制劑,主要有西格列汀、利格列汀、維格列汀、沙格列汀和阿格列汀,均為進(jìn)口原研,國內(nèi)無仿制上市。維格列汀2019年專利到期,豪森藥業(yè)維格列汀成功進(jìn)入仿制藥上市優(yōu)先審批。不出意外的話,豪森糖尿病又一重磅品種維格列汀將成為首仿產(chǎn)品。
2016年,國內(nèi)樣本醫(yī)院單方制劑DPP-4抑制劑銷售額為1.83億元。其中,西格列汀為8246萬元、沙格列汀5226萬元、維格列汀3042萬元、利格列汀1260萬元、阿格列汀561萬元。
目前豪森的糖尿病產(chǎn)品線主要有3款產(chǎn)品:瑞格列奈二甲雙胍片、 瑞格列奈片、格列齊特緩釋片。在主要產(chǎn)品中,瑞格列奈片是內(nèi)分泌線重要品種,豪森瑞格列奈2016年樣本醫(yī)院銷售額為4972萬元,是豪森內(nèi)分泌產(chǎn)品線銷售額主要貢獻(xiàn)者。維格列汀如能首仿獲批,將為豪森糖尿病產(chǎn)品線再添一個重磅產(chǎn)品。